Sorveglianza postmarketing dei vaccini - AIFA
Il monitoraggio post-marketing della sicurezza dei vaccini è di fondamentale importanza per la valutazione continua del profilo beneficio/rischio dei vaccini, per la programmazione delle campagne vaccinali ed anche per fornire informazioni trasparenti ed aggiornate in merito alla sicurezza dei vaccini ed alle attività di controllo condotte a livello nazionale e globale. In questo contesto di massima trasparenza e corretta informazione si colloca il Rapporto Vaccini che, sin dalla sua prima pubblicazione nel 2011, si propone di descrivere con cadenza annuale o biennale le attività di farmacovigilanza relative ai vaccini, condotte in Italia dall’Agenzia Italiana del Farmaco (AIFA) in collaborazione con l’Istituto Superiore di Sanità e con il Gruppo di Lavoro per la Vaccinovigilanza.
Tali attività consistono nel monitoraggio e nella valutazione delle segnalazioni di sospette reazioni avverse ai vaccini inserite nella Rete Nazionale di Farmacovigilanza (RNF) sia dagli operatori sanitari sia dai cittadini. Ogni segnalazione viene valutata per:
- gravità: i criteri di gravità si basano sulle definizioni stabilite dalla Conferenza Internazionale sull’Armonizzazione recepite dalla normativa europea e nazionale (Direttiva europea 2001/83/EC recepita dal D. Lgs. 219/2006)
- esito: l’esito è codificato a livello internazionale (i possibili esiti sono i seguenti: “risoluzione completa”, “miglioramento”, “non ancora guarito” e “risoluzione con postumi”) e si riferisce all’informazione disponibile al momento della segnalazione
- nesso di causalità: questa valutazione consiste in una stima della probabilità che l’evento segnalato possa essere correlato o meno con la vaccinazione e si effettua con metodica standardizzata e condivisa a livello globale (algoritmo OMS. https://www.who.int/vaccine_safety/publications/gvs-aefi/en)
Dall’ultimo Rapporto pubblicato- “Rapporto Vaccini 2019. La sorveglianza Postmarketing in Italia”- emerge che il totale delle segnalazioni inserite nel 2019 e valutabili ai fini dell’analisi descrittiva generale è stato di 6.757, di cui Il 78% (n. 5.270) si riferisce a sospetti eventi avversi verificatisi nel 2019, il 20% circa (n.1.339) a casi avvenuti negli anni precedenti ed il 2,2% (n. 148) non riporta la data di insorgenza dell’evento.
Indipendentemente dalla classe di età, dalla gravità e dal nesso di causalità, nel 2019 il tasso di segnalazione è stato pari a 22,3 segnalazioni ogni 100.000 dosi somministrate per tutti i vaccini e le segnalazioni relative a reazioni gravi correlabili al vaccino sono state 2,9 per 100.000 dosi.
TIPOLOGIA DI REAZIONI AVVERSE SEGNALATE NELL’ANNO 2019:
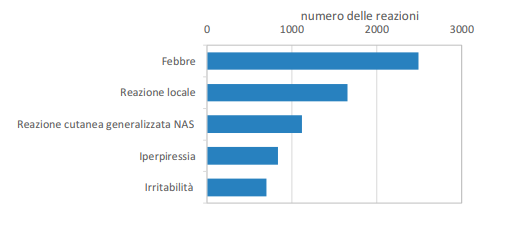
- Le reazioni avverse più frequenti (>1.000 eventi) sono note ed attese e sono rappresentate da febbre (temperatura corporea ≥38°), reazioni locali nel sito di inoculazione e reazioni cutanee generalizzate (incluse le reazioni del tipo rash cutaneo) . Per la maggior parte dei vaccini queste reazioni avverse sono descritte nei riassunti delle caratteristiche del prodotto (RCP) come molto comuni e comuni.
- Meno comuni (>500 e <1.000 eventi) sono risultate le reazioni avverse irritabilità e iperpiressia (temperatura corporea ≥39,5°). Anche in questo caso si tratta di reazioni avverse note e riportate nei riassunti delle caratteristiche del prodotto con frequenza compresa tra comune e non comune.
- Più raramente (sotto i 500 eventi complessivi) sono state osservate altre reazioni avverse note come nausea, vomito, orticaria, pianto, dolore, diarrea, iporeattività, cefalea, disturbi del sistema nervoso autonomo ( ipotensione, lipotimia, sudorazione, ecc.), edema, debolezza e inappetenza.
- Le altre reazioni avverse si collocano sotto il valore dei 200 eventi e rientrano fra gli eventi rari ma attesi, come per esempio le convulsioni febbrili.
- Alcune reazioni avverse sono state riportate con una frequenza estremamente bassa (meno di 20 eventi) e sono caratteristiche di specifici vaccini
ESITO:
Nell’81% dei casi le segnalazioni hanno riguardato reazioni non gravi e, in merito all’esito (noto nel 92% di questi casi non gravi), la reazione avversa era già risolta o in fase di miglioramento al momento della segnalazione. Per quanto riguarda le segnalazioni di eventi gravi (19% del totale) nel 65% dei casi l’evento si è rivelato transitorio con risoluzione completa, il 16% era caratterizzato da un miglioramento al momento della segnalazione, nel 7% delle schede non è stato riportato l’esito ed il 2% presentava una risoluzione con postumi ma occorre sottolineare che l’attribuzione di tale esito è risultata frequentemente erronea. Nell’1,2% delle segnalazioni l'esito riportato è stato il decesso ma nessuna di queste segnalazioni è risultata correlabile con la vaccinazioni.
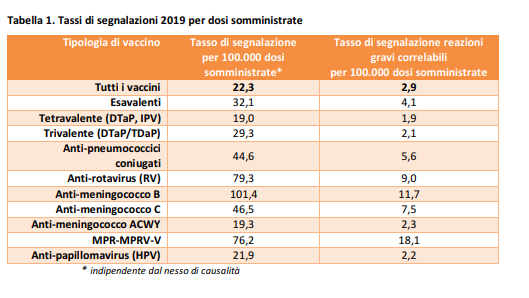
Dal confronto con il Rapporto precedente (anno 2018) si riscontra per tutti i vaccini una lieve flessione del tasso di segnalazione indipendente dal nesso di causalità, verosimilmente imputabile sia alla chiusura di alcuni progetti di farmacovigilanza attiva, sia all’aumento del numero di dosi somministrate nell’anno. Tale flessione non si osserva, invece, in maniera uniforme per i tassi di segnalazione delle reazioni gravi correlabili, dove si osservano riduzioni significative per esavalenti, tetravalente e trivalente, nonostante l’aumento delle coperture vaccinali e il recupero degli inadempienti, e un incremento per i vaccini anti-pneumococco, anti-rotavirus, anti-meningococco B e anti-morbillosi. Nella maggior parte dei casi si tratta di segnalazioni relative all’iperpiressia e alle reazioni cutanee, con esito costituito prevalentemente dalla risoluzione completa. Tutte le sospette reazioni avverse osservate nel 2019 non hanno evidenziato eventi potenzialmente in grado di modificare la valutazione del rapporto fra benefici e rischi dei vaccini utilizzati, non sono emerse concentrazioni temporali o geografiche di segnalazioni per specifici lotti indicative di possibili difetti di qualità. Eventi clinicamente gravi e potenzialmente correlabili si sono verificati raramente, non sono stati associati ad esito fatale e confermano il profilo beneficio-rischio del vaccino, ovvero si sono presentati con una frequenza molto più bassa rispetto ai rischi associati alle malattie che il vaccino previene.



